Bioequivalencia y biodisponibilidad
Se define la bioequivalencia como la intercambiabilidad de dos especialidades farmacéuticas que tienen el mismo principio activo y biodisponibilidad equivalente. Esta definición nos conduce a la de biodisponibilidad, que hace referencia a la cantidad de fármaco que llega en forma activa a la circulación y la velocidad a la que accede a ésta, es decir, la fracción de medicamento capaz de llegar al lugar de acción. Depende de las características fisicoquímicas del principio activo, de los excipientes, del proceso de fabricación y de la conservación de la forma farmacéutica, y también de las características intrínsecas al individuo, como la motilidad intestinal o el pH gástrico.
Cualquier modificación en alguno de estos factores puede alterar tanto la cantidad total de principio activo absorbido como la velocidad a la que se absorbe. Por ello en el desarrollo de una especialidad farmacéutica genérica, a pesar de que se trata del mismo principio activo, la misma dosis y la misma forma farmacéutica, dichos factores pueden determinar una biodisponibilidad distinta a la del producto de referencia.
En consecuencia, dos especialidades farmacéuticas presentan una biodisponibilidad equivalente si tanto la concentración del fármaco activo como la velocidad a la que accede a la circulación sistémica se encuentran dentro de un intervalo considerado equivalente, cuando se administran a las mismas dosis y bajo las mismas condiciones experimentales.
Estudios de bioequivalencia
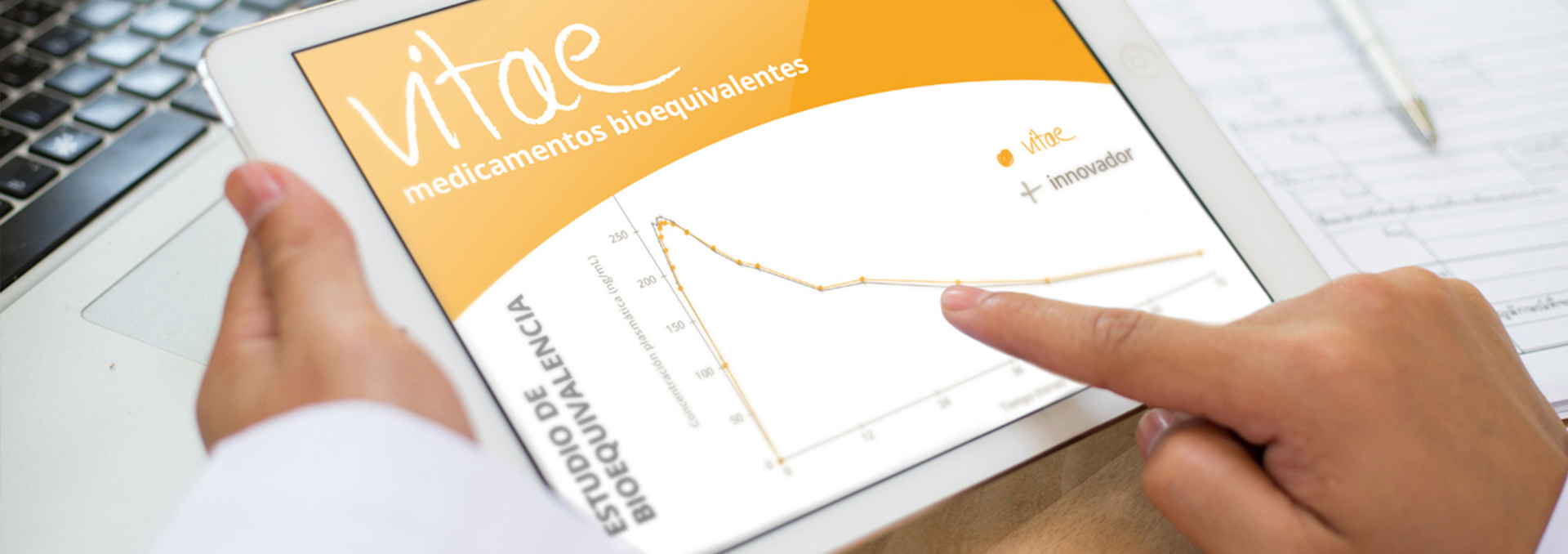
Los estudios de biodisponibilidad demuestran la bioequivalencia entre dos especialidades farmacéuticas. Estos estudios se realizan mediante ensayos clínicos controlados, normalmente cruzados y a doble ciego, en grupos de 12 a 36 voluntarios sanos asignados de forma aleatoria, cumpliendo los requisitos definidos en la Directriz sobre la Investigación de Biodisponibilidad y Bioequivalencia de la Agencia Europea de Evaluación de Medicamentos. Estos requisitos coinciden con los exigidos por Estados Unidos.
Parámetros farmacocinéticos
Los parámetros farmacocinéticos requeridos para determinar la biodisponibilidad de una especialidad farmacéutica son:
- La concentración plasmática máxima (Cmáx)
- El tiempo en que se alcanza la Cmáx (Tmáx)
- El Área Bajo la Curva de la concentración plasmática en el tiempo (ABC o AUC en terminología anglosajona), que cuantifica la cantidad total de principio activo absorbido.

¿Qué garantías ofrece la bioequivalencia?
Cuando se emite la bioequivalencia entre una especialidad farmacéutica genérica (EFG) y la especialidad de investigación original, la administración sanitaria avala que la respuesta del paciente (eficacia clínica) a ambas especialidad será similar.
La bioequivalencia entre una especialidad farmacéutica genérica (EFG) y la especialidad de investigación original, garantiza a todos los profesionales sanitarios que sus efectos en términos de eficacia y seguridad serán esencialmente similares, y consecuentemente las dos especialidades serán intercambiables. Es decir, una de ellas puede sustituir a la otra en el tratamiento de una enfermedad o un síntoma en el paciente.
Garantías Clave